1.4. La iodopsine
Figure 1-6. Molécule de iodopsine M
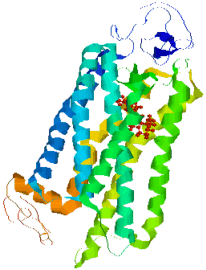
Figure 1-6: Une représentation d'une molécule de iodopsine M. Au centre, en rouge, le rétinal, et en diverses couleurs, les 7 hélices alpha de l'opsine qui l'entoure (logiciel RasMol).
Au niveau du segment externe des cônes et des bâtonnets, imbriquées dans la membrane des lamelles, se trouvent les molécules interagissant avec la lumière: la rhodopsine, aussi appelée pourpre rétinien (à cause de sa couleur qui tend vers le rose), dans le cas des bâtonnets, et les iodopsines dans le cas des cônes. Ces pigments visuels sont similaires, nous verrons ici comment, mais les recherches ont été plus approfondies dans le domaine de la rhodopsine, tout simplement à cause de la différence de nombre entre les bâtonnets et les cônes. Nous étudierons ici la iodopsine, le pigment des cônes. Il est en fait constitué de l'union de deux molécules, le rétinal et l'opsine, qui sont toutes deux essentielles pour la vision.
Le rétinal est une molécule dérivée de la vitamine A, de formule chimique C19H27CHO, liée à l'opsine par liaison C = N. Il a la capacité de s'isomériser en contact avec un photon, ce que l'on appelle la photoisomérisation; il passe alors de sa forme 11-cis-rétinal en tout-trans-rétinal. C'est donc celui-ci qui déclenchera la suite de réactions aboutissant à la vision. Le rétinal est une des formes de la vitamine A présente dans l'organisme, et est synthétisé à partir du rétinol, vitamine A d'origine animale, ou de ß-carotène d'origine végétale. Ceci nous montre l'importance d'avoir un apport suffisant en vitamine A, son manque pouvant entraîner des troubles visuels: l'héméralopie, une diminution anormale de la vision dans l'obscurité. Ce rétinal est le même pour les bâtonnets et les différents types de cônes.
Par contre, la partie protéique, appelée opsine, diffère pour les photorécepteurs différents et est constituée d'un enchaînement d'acides aminés enroulés en sept hélices alpha. Le rétinal est attaché à la septième hélice de cette molécule, au niveau l'acide aminé n° 312, une lysine. Chez les bâtonnets et le cône S, l'opsine est constituée de 348 acides aminés, tandis que chez les cônes L et M, elle en comporte 364. Sur ces acides aminés, seulement 40% sont communs entre opsines S et M, tandis que uniquement 15 d'entre eux diffèrent entre L et M. Ces différences nous suggèrent que la plage de longueur d'onde absorbée est déterminée par les différences dans la structure de la protéine. En effet, il a été démontré par expérience que la substitution de quelques-uns des acides aminés de l'opsine du cône M par leurs homologues dans celle du cône L permet de passer de l'un à l'autre. La sensibilité du rétinal est donc conditionnée par la protéine qui l'entoure.
La iodopsine est en fait présente sous ses 3 formes au niveau des cônes différents. Qu'est-ce qui crée alors la différence entre les cônes? La proportion des pigments présents. Par exemple, pour un cône S seront présents 105 iodopsines S pour 1 M et 1 L. Ceci entraînera des signaux nerveux différents pour les longueurs d'onde différentes.
On peut donc voir la iodopsine comme une molécule à la base de la vision des couleurs, et nous verrons plus tard comment elle agit.
